di Sergio Mauri
Solvatazione: quando il solvente circonda ogni particella di soluto. (Nel caso dell’acqua si parla di idratazione)
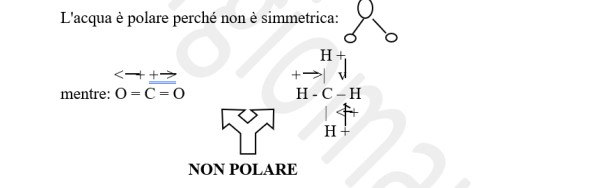
Componenti polari: la polarità è una proprietà delle molecole per cui una molecola (detta polare) presenta una carica parziale positiva su una parte della molecola e una carica parziale negativa sulla parte opposta di essa. Le molecole che non presentano il fenomeno della polarità sono dette apolari o non polari.
Componenti ionici: Il legame ionico è un legame di natura elettrostatica che si forma quando gli atomi possiedono un’elevata differenza di elettronegatività, ovvero una bassa energia di ionizzazione e un’alta affinità elettronica. In termini stretti, esso si riferisce alla mutua attrazione elettrostatica che si instaura tra le cariche elettriche di un catione e di un anione che instaurano tale genere di legame.
Dissociazione: è la scissione parziale o completa di una molecola.
Elettronegatività: è definita come l’attrazione che un nucleo atomico esercita sugli elettroni di legame.
Legge di Coulomb: è la forza esercitata da un campo elettrico su una carica elettrica. Si tratta della forza che agisce tra oggetti elettricamente carichi, ed è operativamente definita dal valore dell’interazione tra due cariche elettriche puntiformi e ferme nel vuoto.
Solubilità: 3 fasi: 1) distacco particelle di soluto
- distacco particelle di solvente coinvolte nella solvatazione
- unione delle particelle di solvente e soluto
Elettrolita: In chimica, con il termine elettrolita si indicano genericamente le sostanze che in soluzione o allo stato fuso subiscono la suddivisione in ioni delle loro molecole.
[Vedi: phet.chimica e Padlet ]
SIMBOLI
N > numero di Avogadro = 6,022 · 10 (alla 23) (una mole di “oggetti” ne contiene sempre lo stesso numero)
m = massa della sostanza [m] (unità di misura della grandezza) = g
MA = massa atomica (si trova sulla tavola) [MA] = u m a
(peso)
MM = massa molecolare (somma delle masse atomiche dell’unità formula) [MM] = u m a
M = massa molare (massa di una mole) [M] = g
n = numero di moli [n] = mol